猫传染性腹膜炎的诊断支持现有检测的最新证据(2018)

临床相关性:猫冠状病毒(FCoV)感染在猫中非常常见,通常只会引起腹泻等轻微的肠道症状。然而,高达10%的FCoV感染会导致致命的猫传染性腹膜炎(FIP)。
临床挑战:基于非侵入性方法获得FIP的明确诊断是困难的。该病的确诊依赖于发现与FCoV抗原免疫染色阳性相关的适当细胞学或组织病理学变化。在有积液的FIP病例中,对积液样本进行细胞学检查和免疫染色相对容易;否则,获得诊断样本更具挑战性,需要从有大体病变的组织中收集活检。在没有明确诊断的情况下,从猫的信号和病史,结合临床检查和实验室检查结果,可以高度怀疑FIP。如果与FIP基本一致,这些结果可以作为与患者讨论是否需要额外的、更具侵入性的诊断测试的基础。在某些情况下,安乐死可能是作为一种选择来讨论的,而不是在死前进行明确的诊断,特别是如果存在经济限制,或者有人担心猫是否能承受侵入性诊断程序。理想情况下,诊断应在这类患者的尸检样本中得到证实。
全球重要性:只要猫中存在FCoV感染,FIP就会发生,这相当于世界上的大部分地区。
证据基础:这篇综述全面概述了如何进行FIP的诊断,重点介绍了兽医可用的试验和最近发表的支持其应用的证据。
什么是冠状病毒?
冠状病毒是大型、有包膜、正单链RNA病毒,其非节段基因组长度约为30,000个核苷酸。猫冠状病毒(FCoV)与犬冠状病毒(CCoV)一样,是甲冠状病毒的一个亚种。冠状病毒在RNA复制过程中表现出高突变率,因此作为遗传多样性群体的集群存在,称为准物种。这种遗传多样性,以及与其他冠状病毒株重组的可能性,与它们的致病性和跨物种传播有关。FCoV似乎出现在20世纪50年代,可能是由于跨物种传播,现在发现世界各地的猫都感染了FCoV,只有少数地区的猫除外,如加拉帕戈斯群岛和福克兰群岛,这可能是由于它们偏远的岛屿栖息地造成的隔离。
FCoV血清型
公认有两种所谓的FCoV血清型:1型,代表在自然感染的猫中发现的绝大多数野外毒株,尽管存在地理变异;以及在1型FCoV和CCoV之间的重组事件之后出现的2型。这两种FCoV血清型主要通过它们的跨膜刺突基因和蛋白质的遗传和血清学差异来区分。S蛋白(图1)很重要,因为它是FCoV与宿主(猫)受体结合的部分,介导宿主细胞进入。2型FCoV的S蛋白类似于CCoV的S蛋白,并且像CCoV一样,2型FCoV使用氨肽酶N作为它们的猫宿主细胞受体。1型FCoVs的受体未知。
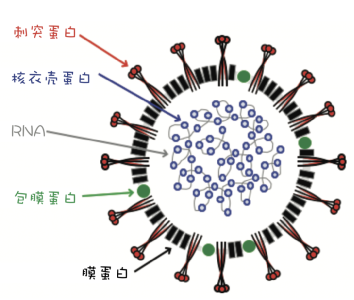
图1. FCoV粒子的示意图。刺突蛋白与猫受体结合,介导宿主细胞进入。已知猫受体是2型FCoV的氨基肽酶N,但对于1型FCoV尚不清楚。经Emi Barker博士许可修改
FCoV与猫传染性腹膜炎的复杂关系
FCoV感染在猫身上很常见。大约40%的家猫感染了FCoV,在多猫家庭中,这一数字增加到90%。猫科动物饲养的现代趋势(例如,更多的猫被饲养在室内和多猫家庭)可能导致FCoV相关疾病的增加。
FCoV的自然感染在约70%的猫中是短暂的,但持续感染发生在约13%的猫中。这些持续感染的肛门有时被称为“携带者”或“长期排毒”的猫。在大多数情况下,FCoV感染是无症状的,或只导致轻微的胃肠道临床症状(如食欲不振、腹泻、呕吐),尽管有时会出现更严重的胃肠道疾病。有趣的是,大约5-10%的猫被认为对FCoV感染有抵抗力。然而,在一小部分病例中,FCoV感染会导致猫传染性腹膜炎(FIP),这是一种致命的疾病,是幼猫的常见死亡原因。据报道,偶尔会在多猫家庭或收容所爆发FIP(当更大比例的猫受到影响时),而且最近可能会增加频率。FIP治疗目前是可行的,包括蛋白酶抑制剂在内的一些新的治疗方法显示出了希望。
以前认为无症状的FCoV感染仅限于肠道,但我们现在知道,健康的FCoV感染的猫可以发生系统性感染,尽管病毒载量低于FIP猫。
FIP发展的因素
病毒因子
病毒因子在FIP的发病机制中很重要。如第228页的方框所述,FCoV的S蛋白介导宿主细胞进入。S蛋白包含一个推定的融合肽,它能够使FCoV包膜与宿主细胞膜融合。S基因的突变可导致转录的S蛋白中的氨基酸取代,从而影响FCoV的嗜性。研究已经确定了FCoV S基因的融合肽序列中的突变,这些突变被认为是FIP的标志,以及密切相关的弗林蛋白酶切位点的变化,这些变化也被认为与FIP相关。最近,已经发现融合肽突变很可能是系统性FCoV感染的标志,其可发生在FIP和非FIP猫中,而不是FIP本身。然而,这些突变仍然是重要的,因为可能通过这些和/或其他突变,FCoV获得了其单核细胞/巨噬细胞嗜性,这使其能够在肠道外全身传播,并有助于FIP的发展。
介导单核细胞中有效和持续复制的其它病毒因子,以及被感染的单核细胞的活化,对于系统性FCoV感染后FIP的后续发展也可能是重要的。
宿主因素
宿主因素也很可能在FIP发展中发挥重要作用。这些包括宿主免疫反应(例如,发生FIP的猫会出现T淋巴细胞耗竭)、单核细胞维持FCoV复制的能力、繁殖和遗传。
环境因素
环境因素,如家庭的压力水平和过度拥挤,也可能起作用。这些可能会加速单只猫的病毒复制速度,这可能会增加病毒突变体的产生并支持FIP的发展。
如何获取诊断
传统上,FIP的明确诊断依赖于组织的组织病理学检查,通常通过FCoV抗原的免疫组织化学(IHC)检测病变内的病毒。渗出液样本中FCoV抗原的免疫染色也是一种选择,如果渗出液显示出与FIP一致的生化和细胞学特征。
组织病理学检查、渗出液分析和FCoV抗原免疫染色将在后面详细讨论。
获得高度怀疑指数
在缺乏明确诊断的情况下,从背景信息、临床症状和常规临床病理结果中可以获得高度怀疑FIP的指数。根据经验,这可以作为与主人讨论是否需要额外的、更具侵入性的诊断检查(例如,受影响组织的外科活检)的基础。在这种情况下,安乐死可能会被讨论作为一种选择,而不是在死前进行明确的诊断;这在例如收容所的猫中可能是优选的,在那里存在经济限制,或者当猫病得很重并且担心患者耐受进一步诊断程序的能力时。
如果在没有明确诊断的情况下实施安乐死,强烈建议进行死后检查,且进行起来相对简单。这样既可以评估与FIP一致的总体变化(图2 ),也可以取样进行组织病理学检查。如果经济限制排除了后者,则值得联系对FIP感兴趣的研究人员(如University of Bristol Feline Coronavirus Research Group and Bristol-Zurich FIP Consortium),看看是否正在为研究寻找样本,以便以较低的成本或免费进行分析。
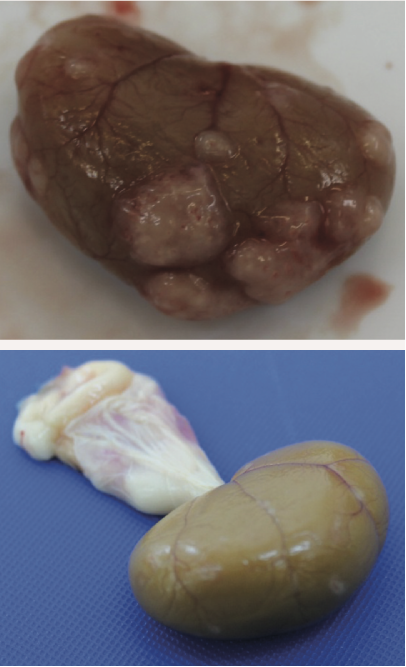
肾脏表面明显的肉芽肿
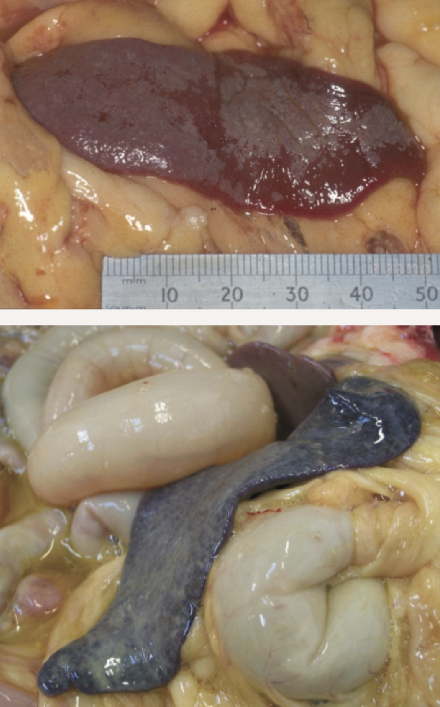
脾脏表面可见纤维素性斑块
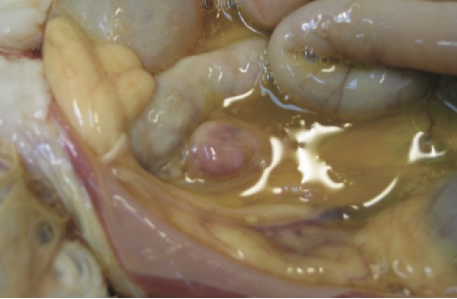
腹部可见黄色粘稠积液
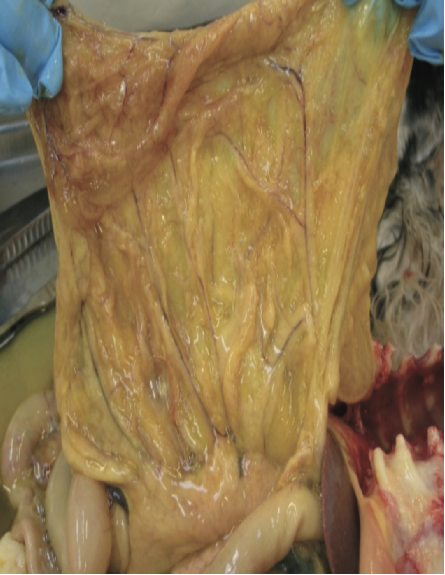
网膜上可见纤维素斑块,同时肠系膜淋巴结肿大
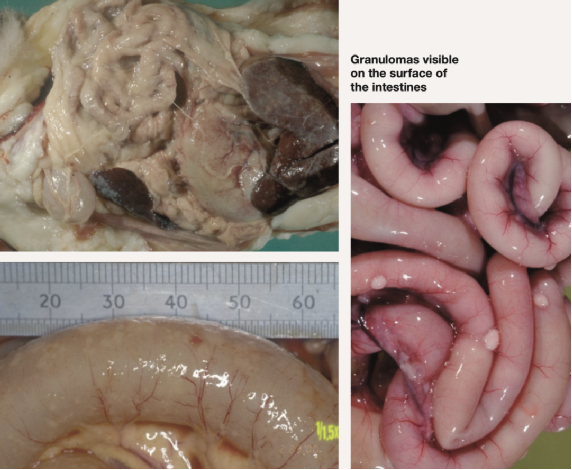
肠道表面可见的肉芽肿
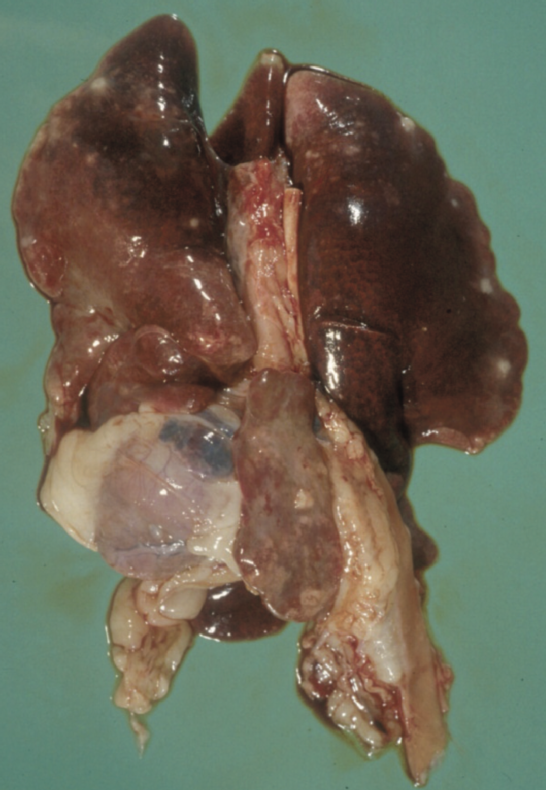
肺部表面可见的肉芽肿
图2 .FIP病例典型的大体尸检结果。腹腔或胸腔内可见器官肉芽肿性病变或器官浆膜上的纤维素性斑块;适合检查的组织有肠系膜淋巴结、肝、脾、肾和肠表面,以及腹壁和膈肌的腹膜内层。在渗出性病例中,可以在胸膜腔和/或腹膜腔中看到黄色粘稠液体,但也可以检查心包是否有液体。
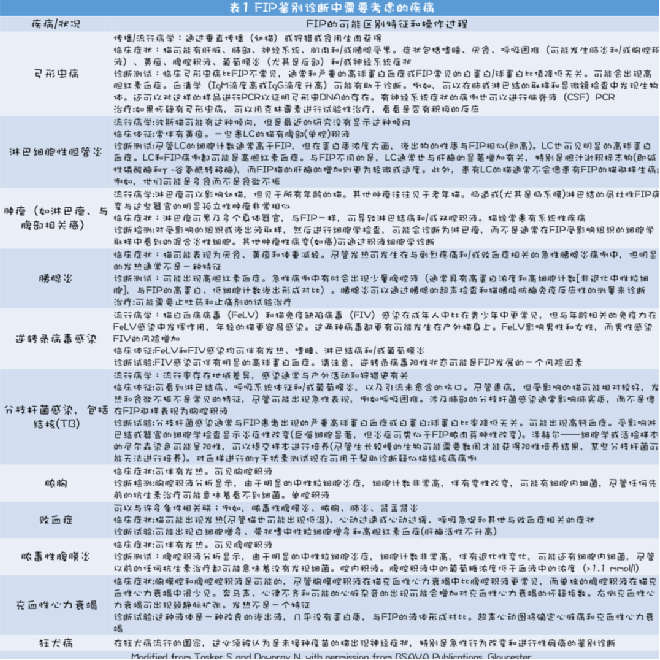
对于怀疑感染FIP病毒的猫,应考虑许多重要的鉴别诊断,如弓形体病、分枝杆菌感染和淋巴细胞性胆管炎。这些疾病和其他疾病在表1中进行了描述,并考虑了这些疾病与FIP病的区别特征。
FIP的特征和背景证据
应该记住,FIP在幼猫(3岁以下的猫,尤其是2岁以下的小猫)中最常见,但在10岁以上的猫中出现较小的病例峰值。雄猫的风险也略高。一些国家的一些品种可能容易患FIP,但这可能是由于这些国家的这些品种存在未知的特定遗传风险因素,并且可能不存在普遍的品种倾向。最近的压力史(收养、收容所、绝育、上呼吸道疾病、疫苗接种等)可能很明显,并可能在引发FCoV感染猫FIP的发展中发挥作用。
尽管生活在多猫家庭中会增加FCoV血清阳性的可能性,但最近的一项大型研究发现,大多数因FIP而被送往医院的猫都来自诊断时只有少量猫的家庭。
临床症状
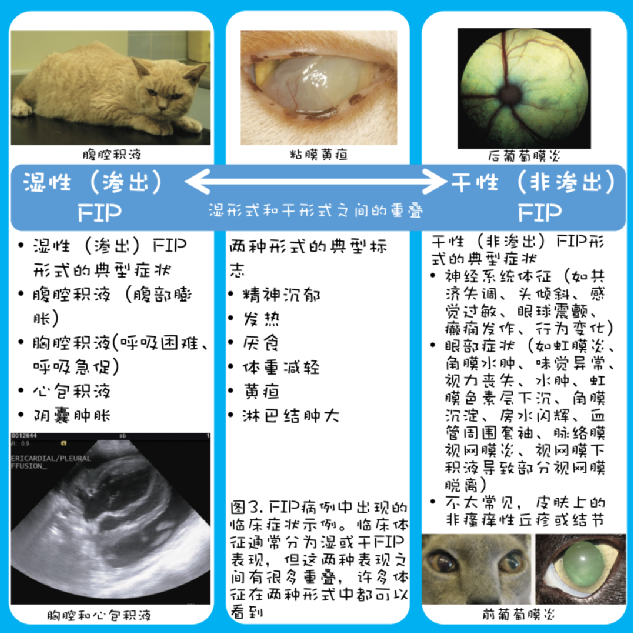
FIP通常表现为一种导致(“湿”)渗出的血管病变(高达80%的FIP病例有渗出),或导致(“干”)肿块病变的肉芽肿形成,或两者的结合;事实上,大多数有积液的FIP病例在尸检时也可见肉芽肿性病变。
渗出性和非渗出性FIP的临床症状(图3)包括嗜睡、厌食、体重减轻(或年轻猫体重增加失败/生长迟缓)、发热,通常对抗生素或非甾体类抗炎药等药物无反应,有时还会出现黄疸(在渗出性FIP中更常见)。
最近一项评估有发热病史的转诊猫病例的研究发现,FIP是最常见的诊断(20.8%,22/106只猫),这表明FIP作为该转诊猫群体中发热猫的鉴别诊断的重要性。另一项仅描述FIP病例的研究报告称,81%的猫体温超过39.5°C,39%的猫体温超过40°C。37与神经系统非渗出性FIP相比,渗出性FIP的猫发热更为常见。
淋巴结肿大也可以出现在渗出型和非渗出型FIP中。
渗出性(湿性)FIP可能涉及腹部、胸膜和/或心包(偶尔也发生在公猫的阴囊),通常性质非常急性,在几天或几周内发展,严重限制存活。这些猫可能出现呼吸困难、呼吸急促和/或腹部膨胀。
非渗出性(干性)FIP通常与神经系统体征(可为局灶性、多灶性或弥漫性,通常伴有中枢前庭体征,偶尔表现为T3-L3脊髓病)和/或眼部体征(前葡萄膜炎和/或后葡萄膜炎)有关,并且更为慢性,进展时间为数周至数月。干性FIP中也有皮肤病体征(典型表现为小的、多发的、非瘙痒性丘疹或结节)的报道。
肾脏肿大可能发生在非渗出性FIP并累及肾脏。偶尔会报告弥漫性化脓性肉芽肿性肺炎。
重要的是要记住,FIP的临床体征会随着时间的推移而改变,因此重复的临床检查对于发现新的明显体征非常重要(例如,少量积液的出现,视网膜检查可见的眼部变化)。
局灶性非渗出性FIP偶尔发生,通常表现为可触摸的腹部肿块。诊断起来特别困难,因为病变很难与肿瘤和分枝杆菌感染区分开来。局灶性FIP病例的报告包括猫因坏死性肉芽肿性淋巴结炎而出现肠系膜淋巴结肿大,或结肠或回盲结肠交界处的孤立性附壁肠道病变伴相关区域淋巴腺病。患有局灶性肠FIP的猫有呕吐和腹泻的病史。
常规实验室检查可能的结果
血液学
FIP的血液学变化是非特异性的,但有许多异常可以用来支持诊断。淋巴细胞减少症特别常见(55-77%的病例,尽管最近的一项研究发现只有49.5%的FIP病例是淋巴细胞减少症),还报告了中性粒细胞增多症(39-57%)、左移和轻度至中度正常细胞、正常色素性贫血(37-54%)。最近报道了FIP与微细胞增多症(伴有或不伴有贫血)之间的关联。严重的免疫介导的溶血性贫血(IMHA),以及相关的再生性贫血,可与FIP一起发生,但并不常见。
血清生物化学
FIP病例的血清生物化学变化是多种多样的,通常是非特异性的,但有许多重要的异常情况需要寻找来支持FIP的诊断。
高球蛋白血症
据报道,89%的病例出现高球蛋白血症,通常伴有低白蛋白血症或正常偏低血清白蛋白(64.5%的病例出现)。低蛋白血症与高球蛋白血症并存意味着高蛋白血症可能并不总是发生;过去的报告记录了高达60%的病例出现高蛋白血症,尤其是在干性FIP病例中,但最近报告的发病率较低,为17.5%。
高球蛋白血症和低白蛋白血症或低正常白蛋白浓度的组合也意味着白蛋白:球蛋白(A:G)比低,该参数可用于评估FIP在个别病例中的可能性。关于A:G比值在FIP诊断中的有用临界值的报道各不相同,但有人认为,A:G比值为0.4表明FIP很可能发生,而A:G比值为0.8则表明FIP很不可能发生。虽然这些临界值是有用的考虑,作者没有使用一个特定的值,但看A:G比与其他诊断测试结果;该值越低,对FIP的怀疑越大,特别是当其他检查结果与FIP的诊断一致时。有趣的是,一项对FIP患病率较低的猫群(类似于兽医临床中经常遇到的情况)的研究发现,0.6的A:G比率有助于排除FIP,但较低的比率对判定FIP没有帮助。
此外,FIP病例中报告的低白蛋白血症、高球蛋白血症、低A:G比率和血清蛋白电泳(SPE)异常的频率和程度最近有所下降。关于SPE的变化,在一项研究中,2013-2014年诊断为FIP的病例往往具有升高的α2-球蛋白,而不是2004-2009年病例中出现的升高的γ-球蛋白。这可能是由于兽医诊断FIP较早,这意味着病例没有进展到显示γ-球蛋白升高。多克隆和单克隆γ-球蛋白升高在FIP已有报道,尽管多克隆升高更为常见。
高胆红素血
高胆红素血症发生在21–63%的FIP病例中,尤其见于渗出性FIP,通常丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)或γ-谷氨酰转移酶活性无明显升高(尽管在FIP病例中这些酶活性可中度升高)。由IMHA引起的高胆红素血症在FIP很少见,猫通常不会严重贫血。因此,在没有升高的肝酶活性或严重贫血的情况下,高胆红素血症的存在应提高对FIP的怀疑指数(注意,在没有升高的肝酶活性的情况下,败血症和胰腺炎也可引起高胆红素血症[表1])。一项研究发现,通过对患有FIP病的猫进行连续评估,猫在死亡或安乐死前比首次出现高胆红素血症更常见。此外,这项研究还发现,与首次出现相比,猫在死亡或安乐死前的胆红素水平更高。
急性期蛋白
在许多炎性和非炎性疾病中,肝脏对巨噬细胞和单核细胞释放的细胞因子(特别是白细胞介素1和6以及肿瘤坏死因子α)做出反应,产生急性期蛋白(APPs)。
α1-酸性糖蛋白(AGP)是一种APP,其测定有助于FIP的诊断。尽管AGP升高(>0.48 mg/ml)本身对FIP没有特异性,但在FIP病例中经常看到AGP水平显著升高(>1.5 mg/ml)。因此,增加的幅度可能有助于FIP的诊断,更高的水平更有助于提高怀疑指数。一项研究发现,当FIP的预测试概率很高时(即,历史和临床结果支持FIP),中等血清AGP水平(1.5-2mg/ml)可以区分患有FIP的猫和没有FIP的猫。 但是,只有较高的血清AGP水平(> 3 mg/ml)才能支持对疾病预测概率较低的猫的FIP的诊断(即,病史和临床发现不支持FIP)。55然而,另一项非常小的FIP异常病例研究发现,适度的AGP浓度(> 1.5 mg/ml)仍然能够区分FIP和非FIP病例。
FIP的FCoV血清学
FCoV的血清抗体试验通常是ELISAs、间接免疫荧光抗体试验或快速免疫迁移试验。大多数使用CoV感染的猪或猫细胞作为底物,并在不同倍数的血清稀释液中读取滴度。FCoV抗体检测阳性表明猫已经感染了FCoV,并且已经血清转化(这需要从最初感染开始2-3周)。
已检测到与品种相关的FCoV抗体滴度中值差异,这可能反映了品种对FCoV感染反应的差异。
尽管FIP猫的FCoV抗体滴度往往高于非FIP猫,但有很多重叠,健康猫和疑似FIP猫中的FCoV病毒抗体滴度中值之间没有差异。因此,个体动物的滴度在区分患有FIP的猫方面的用途有限。许多临床健康的猫(尤其是多猫家庭的猫)的FCoV抗体滴度呈阳性,通常非常高,而约10%的FIP猫的血清呈阴性(这可能是由于样本结合抗体中存在病毒,使其无法用于血清学测试),这突出了解释的困难。在疑似干型FIP病例中,FCoV抗体阴性结果可能更有助于排除FIP的诊断;然而,在神经系统FIP的病例中已经报道了阴性结果。因此,临床医生在是否对疑似病例进行血清学检查方面各不相同,尽管阳性结果肯定表明接触了FCoV。
对疑似FIP病例的任何积液样本进行分析对诊断都非常有帮助,因此获取积液样本应该是首要任务。对于胸腔和腹腔内少量液体的检测,超声检查通常被认为比放射检查更敏感,但这可能取决于液体的位置。建议重复超声检查以确定任何少量积液,同样,超声检查可用于引导对少量积液的取样。
FIP渗出液(图4)通常是透明的、粘性的、稻草黄色的,富含蛋白质(细胞学上常描述为浓稠的嗜酸性蛋白质背景),总蛋白浓度> 35 g/l(球蛋白> 50%)。偶尔会有乳糜样渗出。

图4 .FIP典型的积液表现。积液清澈、粘稠,呈稻草黄色
典型的FIP渗出液具有与血清中类似的低A:G比率(见上文)和升高的AGP浓度。最近的一项研究发现,在区分FIP和非FIP病例方面,有效的AGP浓度(>1.55 mg/ml)比血清或其他APPs中的AGP水平更有用(灵敏度和特异性为93%);然而,在本研究中,猫FIP的“诊断”并不总是通过组织病理学和免疫染色来证实。
FIP渗出液细胞性差(通常<5 x 109个细胞/L),本质上为典型的化脓性肉芽肿,伴巨噬细胞、非变性中性粒细胞和少量淋巴细胞。因此,根据细胞计数(< 5 x 109个细胞/L),这些通常被描述为改良的漏出液,但根据蛋白质浓度(> 35g/L),则被描述为渗出液。李凡他试验(见下图)是一种简单的现场检测方法,可在渗出液样本上进行,以快速区分渗出液和渗出液。阳性结果仅仅意味着液体是渗出液,因此不是FIP特有的;在非FIP病例中报告了阳性结果(例如,细菌性/脓毒性肠炎和淋巴瘤)。尽管细胞学有时可以成功地诊断细菌性/脓毒性腹膜炎和淋巴瘤,以帮助区分这些疾病和FIP病,但许多兽医可能没有信心在院内进行细胞学检查。

FCoV抗体的血清学试验也可以在渗出液样本上进行,结果差异很大,因此作者没有在FIP疑似病例中进行这项试验。
其他诊断测试
用MRI检查大脑可能有助于发现变化。例如,阻塞性脑积水、脊髓空洞、枕骨大孔疝和脑膜、第三脑室、中脑导水管和脑干的显影增强已在FIP中报道。
脑脊液(CSF)可以从神经系统病例中收集,但应小心,因为脑疝的风险很大。脑脊液可能显示蛋白质浓度升高(> 0.30 g/l脑样本,> 0.46 g/l腰椎样本;偶尔FIP猫显示显著升高> 2 g/l)和细胞计数增加(> 8×106细胞/l腰椎和脑样本;FIP猫的计数可超过1000 x 106个细胞/l,细胞类型主要为嗜神经细胞、单核细胞或混合细胞。一些FIP神经系统病例的脑脊液分析结果并不明显。CSF样本也可用于FCoV RNA的RT-PCR和FCoV抗原的免疫染色(见下文)。
FCoV的RT-PCR
RT-PCR试验可用于FCoV的检测;然而,它们并不特异于FIP相关的FCoVs。FCoV RT-PCR分析同时扩增细胞相关亚基因组mRNA(FCoV复制时产生的短长度转录RNA)以及细胞相关或病毒体相关基因组RNA,每种RNA的相对丰度由引物的定位决定(即PCR过程中引物沿FCoV序列结合的位置)。由于病毒转录始于FCoV基因组的3’端(图6),因此含有病毒3’序列的亚基因组mRNA比含有病毒5’序列的亚基因组mRNA多。 因此,针对基因组5’端(如病毒复制酶复合物基因)的定量分析(即RT-qPCR)比针对基因组3’端(如7a/b非结构蛋白基因)的定量分析更不易受到病毒载量高估的影响。
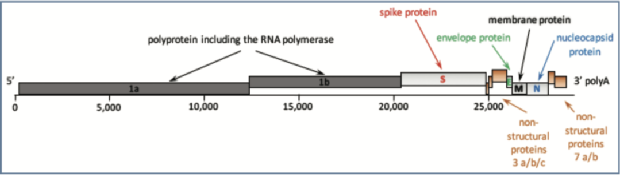
图6.FCoV基因组示意图。FCoV RT-PCR检测FCoV RNA。通过不同的RT-PCR扩增的基因组片段根据测定中使用的引物的位置而变化。由于病毒转录始于FCoV基因组的3"端,在该3"端产生多个亚基因组RNA,因此使用位于基因组3"端(例如,在M或N区)的引物进行的PCR检测将容易受到病毒载量过高估计的影响,因为这些引物将扩增这些亚基因组RNA以及FCoV中存在的基因组RNA。相反,使用位于基因组5"端的引物(如RNA聚合酶)进行的PCR检测将主要扩增基因组RNA,并且不太容易高估病毒载量。针对FCoV基因组3"端的检测在检测FCoV的存在时往往更敏感,因为它们能够扩增亚基因组和基因组RNA。包括FCoV在内的冠状病毒经常发生突变和重组,这意味着设计用于特定序列的PCR可能无法扩增所有FCoV。PCRs可以设计成靶向基因组的保守区域,以最大限度地减少这种情况,但不可能消除FCoV序列变异性作为非扩增的原因。经Emi Barker博士许可修改
实验室应该能够报告他们用于检测FCoV RNA的RT-PCR的敏感性和特异性,并且他们使用的引物的结合位点可以提供一些关于检测是否易于高估病毒载量的指示(见上文)。作为一种RNA病毒,FCoV在复制过程中表现出高错误率,并且引物和/或探针结合位点的任何病毒突变都可能导致PCR检测效率的损失,并最终导致灵敏度的损失。可以改变PCR条件以耐受这种突变,但这会导致特异性的丧失。
如果所用的实验室周转时间快,可以快速报告FCoV RNA的RT-PCR结果;然而,一旦将向实验室提交样本所需的时间计算在内,结果报告仍需要几天时间。这通常比组织样本上的免疫染色更快,并且可能比渗出样本上的免疫染色更快,但是免疫染色可以提供明确的诊断,而RT-PCR不能。最近已经描述了一种用于在内部检测FCoV RNA的快速分子技术(环介导等温扩增),尽管它的灵敏度很低。
哪些样本可以测试?
RT-PCR可用于检测疑似FIP病例的组织、积液、血液、CSF或房水样本中的FCoV RNA(见下框)。组织样本不应被福尔马林固定,因为福尔马林会降解靶RNA并降低PCR灵敏度;事实上,RNA对降解非常敏感,用于研究目的的样本通常被收集到RNA保存液中。然而,RT-PCR用于常规诊断目的的其他样品是否需要特殊的收集条件尚未得到证实。血液、积液、组织、脑脊液和/或房水样本中FCoV RNA的存在(特别是高水平)可以高度支持FIP的诊断,但在作者看来,不能被视为提供明确的诊断。

FCoV RT-PCR也可以对粪便样本进行,但这主要用于识别正在脱落病毒的猫,以便在多猫家庭中管理感染。粪便FCoV RT-PCR不用于帮助诊断FIP,但有趣的是,最近的研究发现,患有FIP的猫比没有FIP的猫更容易脱落FCoV,并且通过RT-qPCR检测,其粪便中的FCoV RNA含量更高。
表征FCoV S基因突变的分子技术
可以使用哪些技术?
在通过RT- PCR检测到FCoV RNA后,可以使用分子技术如焦磷酸测序、Sanger测序或具有序列特异性水解探针的PCR来表征样品中存在的FCoV基因组序列的靶片段。这种技术并不总是成功的;例如,如果仅存在低水平的FCoV(这可能妨碍序列分析),或者如果FCoV序列可变性意味着目标测序技术不能产生序列结果。如果存在FIP特异性突变,FCoV基因组序列的表征将是最有用的,因为这些突变的检测将有助于诊断FIP。
突变分析有用吗?
一篇2012年的论文将FCoV S基因编码的融合肽中的氨基酸差异描述为与FIP相关的FCoV的标记,这增加了检测潜在的S基因突变可用于明确诊断FIP的可能性。类似地,也由S基因编码的弗林蛋白酶切割基序中的氨基酸差异与FIP病相关。然而,这些S基因标记是通过比较在FIP猫的组织中发现的FCoVs序列和在健康的非FIP猫的粪便中发现的FCoVs序列来识别的。
Bristol的作者小组的研究人员假设,融合肽序列突变可以反映FCoV的细胞嗜性(即,系统性单核细胞/巨噬细胞相关的FCoV或肠上皮相关的FCoV),而不是FIP的特异性,知道非FIP猫可以有系统性FCoV感染。他们比较了在FIP猫组织中检测到的FCoV与在非FIP猫组织中检测到的FCoV的S基因序列,这些序列来自先前描述的融合肽突变区域。这允许对非FIP和FIP病例中与系统性FCoV感染相关的FCoVs基因序列进行评估。他们发现在大多数FIP组织中存在的S基因突变也存在于大多数患有系统性FCoV感染的非FIP猫的组织中。
最近,一项更广泛的研究证实了这些发现,并计算出如果将S基因突变的FCoV的鉴定作为RT-PCR检测FCoV的一个额外的确认步骤,这仅略微增加了组织样本中FIP诊断的特异性(从92.6%到94.6%)。敏感性中度降低(从89.8%到80.9%),因为有时会识别出非突变的FCoV,并且不可能在所有组织样本中进行突变分析(例如,由于FCoV拷贝数低或存在2型FCoV)。这些结果质疑了S基因突变分析在RT-PCR检测FCoV之外的价值,特别是考虑到进行这种额外的分析需要额外的费用和时间。
在最近发表的研究中,也对渗出液进行了S基因突变分析。FIP猫感染的大多数FCoVs确实有所描述的突变。在一项研究中,12/17的FCoV阳性FIP积液样本有S基因突变,而1例没有突变,4例由于FCoV水平低而无法测序。在另一项研究中,32/36 FCoV阳性FIP积液样本有S基因突变,而3例没有突变,1例无法测序。
作者小组最近的广泛研究计算出,作为RT-PCR单独检测FCoV的一个额外步骤,S基因突变FCoV的鉴定没有增加体液样本(主要是渗出液,但也包括脑脊液和房水)中FIP诊断的特异性——特异性保持在97.9%——但灵敏度显著降低(从78.4%到60%),原因与组织样本中描述的相同。在这项研究中,所有来自FIP猫的FCoV阳性样本在CSF样本中都有S基因突变,而非FIP样本中没有FCoV阳性。因此,与通过RT-PCR单独检测FCoV RNA相比,在FCoV中进行S基因突变分析并不能显著提高在渗出液或体液样品中诊断FIP的能力。
组织病理学检查
受影响组织的样本,如肝、肾或肠系膜淋巴结,可以在死前通过超声引导经皮针芯活检、腹腔镜检查或剖腹手术收集,尽管收集的侵入性可能会排除在病猫中进行。由于高度怀疑FIP病毒,通常在安乐死后的尸检中收集样本。评估样本的FIP特征性组织病理学变化,当存在时,通常认为诊断是可靠的。FCoV抗原的免疫染色通常也被推荐用于确诊。然而,缺少组织病理学损伤更难解释,尤其是在怀疑FIP指数高的病例中,因为缺少指导活检的大体损伤可能导致未受影响的器官或组织的取样。最近的一项小型研究记录了5/8的FIP病例没有典型的与FIP一致的组织病理学变化,即使进行了大规模的代表性活检;这些病例的诊断基于阳性FCoV抗原免疫染色。
FCoV抗原的免疫染色
免疫染色是使用IHC在福尔马林固定的组织上进行的,或者使用免疫细胞化学(ICC)或免疫荧光(IF)在细胞学(通常是积液)样品上进行的。这些技术利用抗体与宿主细胞相关的FCoV抗原的结合,随后通过产生颜色变化的酶促反应(ICC)或荧光(IF)来观察。
组织的FCoV抗原免疫染色阳性被认为证实了FIP的诊断(即,它是非常特异的);然而,阴性结果并不排除FIP作为诊断,因为FCoV抗原可能在病变内变化分布,因此在从FIP病例的病变制备的所有组织病理学切片中都没有检测到。这在一定程度上与一些人的建议相矛盾,即免疫染色是在可疑病例中确认/排除FIP的强制性规定,尽管可以通过采集多个和/或大的病理学确诊样本,以及可能要求切割和染色病理学活检的额外切片来克服这个问题。
渗出样本的免疫染色显示出不同的敏感性(范围从57-100%)。由于该技术依赖于对渗出液中巨噬细胞内的FCoV抗原进行染色,并且渗出液通常缺乏细胞和/或FCoV抗原被渗出液中的FCoV抗体掩盖,因此可能获得假阴性结果。免疫染色被认为是非常特异的;然而,在一项研究中,7例非FIP积液中有2例(心力衰竭和胆管癌病例)通过IF呈阳性,在另一项研究中,29例非FIP积液中有82例和8例(包括2例心力衰竭和2例肿瘤)通过ICC呈阳性,这就提出了ICC特异性的问题。报告的较差特异性可能是由于一项研究中使用的方法(即使用FCoV抗原和巨噬细胞双重染色[通过主要组织相容性复合体II染色]),以及另一项研究中载玻片的次优储存,这可能导致非特异性染色和假阳性结果。一些人建议,使用从离心渗出样品中产生的细胞沉淀来制备福尔马林固定的石蜡包埋样品,然后可以像IHC的组织标本一样处理,可以提高FCoV抗原检测的可靠性,尽管这需要的处理时间比ICC长。
据报道,FCoV抗原ICC染色成功地检测了患有神经性FIP的猫脑脊液中的FCoV。
最近的一项研究评估了有或没有神经症状的有或没有FIP的猫的脑脊液中的ICC(在死后检查中收集)。这项研究发现,17/20的FIP猫给出了阳性结果,3/18的没有FIP的猫给出了阳性结果,这限制了测试的特异性,尽管方法可能再次成为一个问题。这些分析排除了细胞性不足以进行ICC的病例。将ICC应用于死前收集的大量因FIP和非FIP引起神经症状的猫的脑脊液样本,将有助于进一步评估该技术的实用性。
FCoV抗原免疫染色的使用最近已在对患有和未患有FIP的猫进行尸检时收集的房水样本中进行了描述。该研究评估了25只患有FIP病的猫(有趣的是,其中大多数为渗出性FIP病例,未出现葡萄膜炎)和11只非FIP猫的房水样本中的FCoV ICC。灵敏度为64%,特异度为81.8%。在11只对照猫中的两只中获得阳性结果,一只患有淋巴瘤,一只患有肺腺癌;房水细胞学特征也不符合FIP(化脓性肉芽肿炎症)。在FIP病例中,能够使用房水进行可靠的诊断研究将是特别有价值的,因为它可以在非渗出病例中收集房水,尽管本研究中使用的样本收集技术需要改进(例如,较小规格的针头)以便在死前使用。对从患有由FIP和非FIP原因引起的葡萄膜炎的猫的死前收集的房水样品的ICC的进一步评估将有助于进一步评估该技术的有效性。
细针抽吸物也可能用作FCoV抗原免疫染色的样本,但由于难以靶向病变,敏感性可能较差。需要进一步的研究来评估它们在FIP诊断中的效用,目前没有证据支持这一点。

致谢
ST would like to acknowledge the many contribu- tions made by the University of Bristol Feline Coronavirus Research Group and Bristol-Zurich FIP Consortium to the viewpoints and discussions described in this review. Special thanks go to Emi Barker and Samantha Saunders for their helpful comments on this manuscript, and to Jacqui Norris and Anja Kipar for helpful discussions on FCoV antigen staining. Andrew davidson, Anja Kipar and Stuart Siddell are also thanked for their valued contributions to past and current FCoV research. Additional thanks go to the veterinary practices, cat owners, cat breeders and rescue centres that helped in the acquisition of samples used in these research studies and to colleagues, current and past, at the Feline Centre and Veterinary Pathology Unit, Langford Vets, University of Bristol, who have assisted in obtaining samples.
利益冲突
ST is a member of the World Forum for Companion Animal Vector Borne diseases, supported by Bayer Animal Health, and of the European Advisory Board on Cat diseases, supported by Boehringer Ingelheim. She also does work for the Molecular diagnostic Unit, Langford Vets, University of Bristol.
资金
ST receives financial support for current infectious disease research from BSAVA Petsavers, Journal of Comparative Pathology Educational Trust, Langford Trust, Langford Vets Clinical Research Fund, Morris Animal Foundation, NERC/BBSRC/MRC, Petplan Charitable Trust, South West Biosciences dTP and Zoetis Animal Health.